Enhanced siRNA Delivery a través del acústico microflujo-mediado agrupamiento de nanopartículas

Enhanced siRNA Delivery a través del acústico microflujo-mediado agrupamiento de nanopartículas
Resumen
Se presenta un método novedoso para la entrega de siRNA que aprovecha el microflujo acústico para promover el agrupamiento de nanopartículas lipídicas y aumentar su captación celular. Frente a métodos tradicionales con limitaciones de eficiencia y especificidad, esta aproximación ofrece una solución escalable, biocompatible y altamente ajustable para el silenciamiento génico, mostrando en vitro una mejora aproximada del 30 por ciento en eficiencia de transfección.
Introducción
El silenciamiento génico mediante small interfering RNA siRNA tiene un enorme potencial terapéutico, pero la entrega eficaz a las células diana sigue siendo un reto. Vectores virales y nanopartículas lipídicas LNP son las estrategias más usadas, con problemas como inmunogenicidad, baja eficiencia de transfección y efectos fuera de objetivo. En este trabajo se explora el uso del microflujo acústico para inducir la agregación dinámica de LNP cargadas con siRNA, formando estructuras de mayor tamaño que facilitan la internalización celular y mejoran la eficacia del silenciamiento.
Marco teórico
El microflujo acústico surge de las fuerzas viscocinemáticas generadas por campos de presión oscilantes inducidos por ultrasonidos. Cuando LNP están suspendidas en un fluido y se exponen a estos campos, se generan patrones de flujo localizados que favorecen la formación de agregados. El grado de agregación y las características morfológicas de los agregados se controlan ajustando parámetros ultrasónicos como frecuencia, amplitud y duración de pulso. Se plantea que agregados de mayor tamaño presentan una mayor probabilidad de ser internalizados por las células debido a una difusión mejorada y mayor interacción con receptores de membrana.
Desde la perspectiva física, el movimiento del fluido puede describirse por las ecuaciones de Navier Stokes, donde la densidad del fluido rho, la velocidad v, la presión p, la viscosidad dinamica mu y las fuerzas externas f determinan la dinámica de flujo. La fuerza de radiación acústica aplicada sobre las partículas depende de la compresibilidad del medio y del gradiente espacial de la presión acústica, y permite manipular el tamaño y la estabilidad de los agregados en función de la orientación respecto al haz acústico y la intensidad del campo.
Metodología
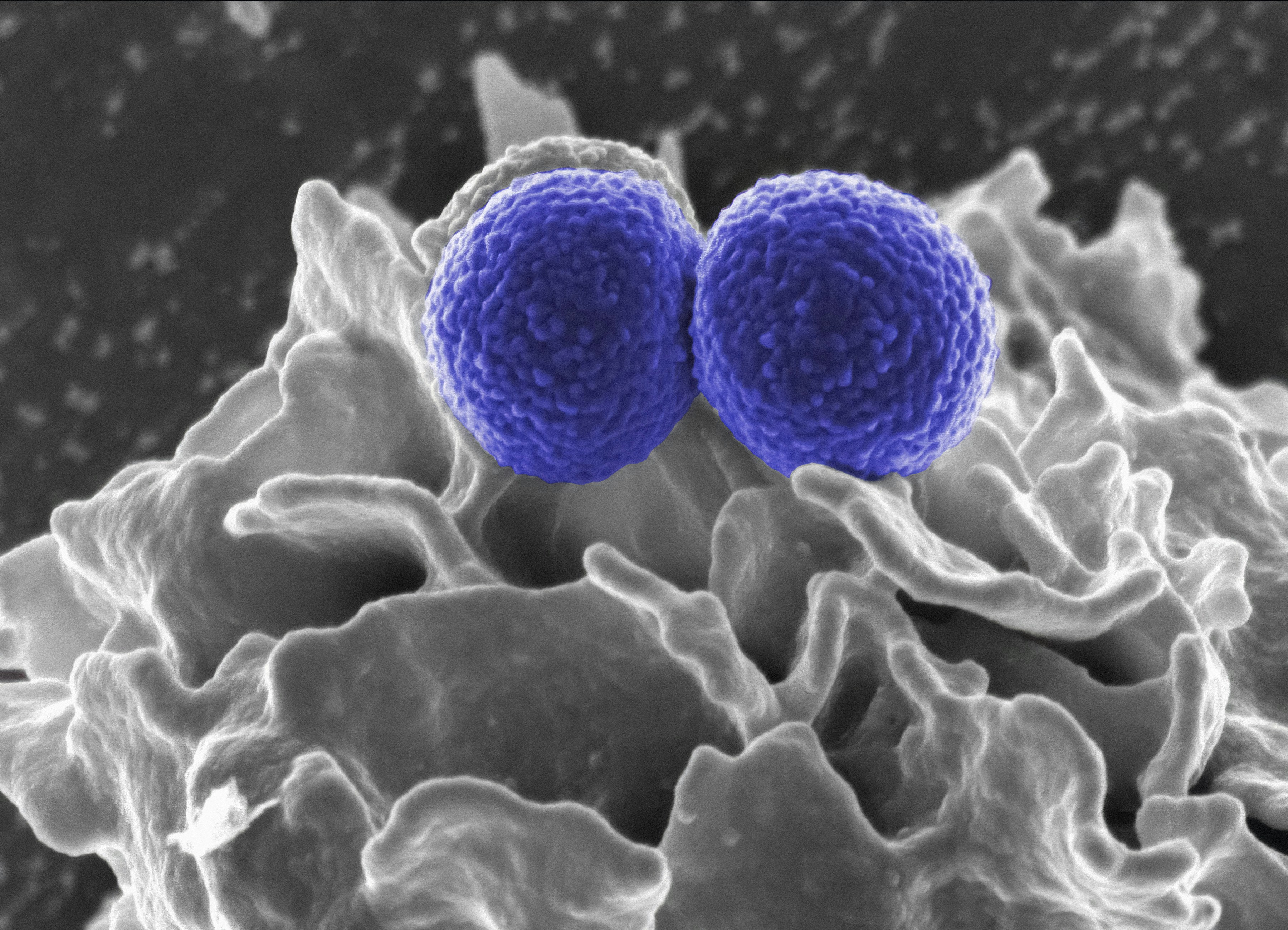
Formulación de LNP Se empleó una formulación LNP estándar incluyendo lípidos catiónicos y neutrales habituales en entrega de ácidos nucleicos, encapsulando siRNA dirigido a un gen sobreexpresado en células HeLa. Preparación acústica Las LNP se suspendieron en PBS y se expusieron a ultrasonidos continuos a baja frecuencia 20 kHz con densidades de potencia entre 0.1 y 1.0 W/cm2. La agregación de partículas se monitorizó en tiempo real mediante dispersión dinámica de luz DLS y se corroboró mediante microscopía óptica y microscopía electrónica de barrido SEM. Transfección celular Células HeLa cultivadas en placas de seis pocillos se expusieron a LNP agregadas y no agregadas a una concentración equivalente de 100 nM de siRNA. Tras 48 horas se evaluó la eficiencia de silenciamiento por qRT PCR y la localización intracelular por microscopía de fluorescencia. Optimización de parámetros Se aplicó una metodología de superficie de respuesta RSM con diseño compuesto central CCD para optimizar frecuencia, amplitud y duración de pulso, modelando la eficiencia de transfección como una función cuadrática de los factores y sus interacciones.
Resultados experimentales
Mediciones iniciales de DLS mostraron que las LNP no agregadas tenían un tamaño medio alrededor de 100 nm con PDI 0.2. Tras exposición a microflujo acústico a 20 kHz y 0.5 W/cm2, se observaron agregados de 1 a 5 micras y una reducción del PDI a 0.15. El análisis por qRT PCR mostró una reducción del 32 por ciento en la expresión del gen diana con LNP agregadas frente a un 18 por ciento con LNP no agregadas, diferencia estadísticamente significativa. La microscopía de fluorescencia confirmó mayor localización intracelular de los agregados. El análisis RSM identificó una región óptima de parámetros acústicos que maximiza la eficiencia de transfección manteniendo la viabilidad celular.
Discusión
Estos resultados apoyan la hipótesis de que la agregación inducida por microflujo acústico mejora la entrega de siRNA al facilitar la interacción partícula célula y la internalización. La técnica ofrece control fino sobre el tamaño y estabilidad de los agregados, lo que podría permitir adaptar la estrategia a distintos tipos celulares y condiciones fisiológicas. No obstante, es imprescindible validar la seguridad y eficacia in vivo, así como estudiar la estabilidad de los agregados en fluidos biológicos complejos y su biodistribución.
Escalabilidad y vías futuras
Corto plazo 1 2 años: miniaturizar el sistema a formato microfluídico para permitir procesos de alto rendimiento y caracterización continua, e iniciar estudios de biocompatibilidad en modelos murinos. Medio plazo 3 5 años: desarrollo de dispositivos acústicos comercializables para aplicaciones clínicas y extensión de la tecnología a la entrega de otros ácidos nucleicos como mRNA y oligonucleótidos antisense ASO. Largo plazo 5 10 años: integración con nanopartículas dirigidas para silenciamiento génico altamente específico en poblaciones celulares heterogéneas y desarrollo de terapias personalizadas.
Aplicaciones prácticas y potencial industrial
La tecnología descrita tiene aplicación inmediata en terapias génicas contra cáncer e infecciones virales y podría transformar el desarrollo de tratamientos dirigidos, impactando significativamente un mercado global de terapia génica valorado en miles de millones. Además, la naturaleza escalable y controlable del método facilita su integración con plataformas de desarrollo y ensayos industriales.
Verificación y reproducibilidad
La verificación se basa en múltiples herramientas complementarias: encapsulación de siRNA en LNP, monitorización en tiempo real de la agregación por DLS, observación morfológica por microscopía y evaluación funcional por qRT PCR y microscopía de fluorescencia. El uso de diseños estadísticos RSM aporta robustez al proceso de optimización y asegura reproducibilidad en distintos lotes experimentales.
Conclusión
El uso del microflujo acústico para mediar el agrupamiento de LNP constituye una estrategia prometedora para mejorar la entrega de siRNA. La técnica combina eficiencia mejorada, biocompatibilidad y control paramétrico, abriendo un camino hacia soluciones de silenciamiento génico más precisas y escalables.
Sobre Q2BSTUDIO
Q2BSTUDIO es una empresa especializada en desarrollo de software y aplicaciones a medida, con experiencia en inteligencia artificial, ciberseguridad y servicios cloud. Ofrecemos soluciones integrales que van desde el diseño de aplicaciones de alto rendimiento hasta la implementación de agentes IA y proyectos de inteligencia de negocio con Power BI. Nuestro equipo combina experiencia en ingeniería de software a medida y conocimientos avanzados en IA para empresas, garantizando implementaciones seguras y escalables en plataformas como AWS y Azure. Si su proyecto necesita un producto a medida, contamos con capacidades para diseñar y desplegar desarrollo de aplicaciones y software a medida y para incorporar modelos de inteligencia artificial que potencien la toma de decisiones y la automatización de procesos.
Servicios y palabras clave para posicionamiento
Aplicaciones a medida software a medida inteligencia artificial ciberseguridad servicios cloud aws azure servicios inteligencia de negocio ia para empresas agentes IA power bi automatización de procesos
Contacto y recursos
Para más información sobre nuestros servicios de ciberseguridad pentesting, nube o business intelligence consulte nuestras páginas especializadas y solicite una consultoría personalizada para llevar su proyecto desde la idea hasta la producción con garantías de seguridad y rendimiento.


Comentarios